| Статистика |
Онлайн всего: 1 Гостей: 1 Пользователей: 0 |
|
 |
ХИМИЧЕСКИЙ ЛАБИРИНТ
Найдите путь, который приведет вас к финишу. Начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжаете путь по стрелке с обозначением «да». Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением «нет». Для полного усвоения сведений, приведенных в лабиринте, выбирайте в качестве исходных разные клетки лабиринта
НАЖМИТЕ НА КАРТИНКУ, ЧТОБЫ УВИДЕТЬ ИЗОБРАЖЕНИЕ
"Порешаем кроссворды"
8 класс скачать здесь
( Нажмите на картинку. чтобы увидеть задания)
Ребус "ШЕСТЬ ЭЛЕМЕНТОВ" Ребус "МЕТАЛЛЫ И НЕМЕТАЛЛЫ"
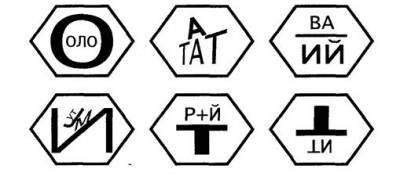 
Калейдоскоп загадок для 8 класса
( Нажмите на картинку. чтобы увидеть задания)
 
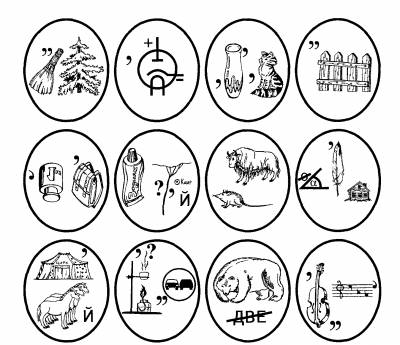
АНАГРАММЫ — это загадки, ответы на которые из одних и тех же букв. Слова БОКАЛ и КОЛБА, например, могут составлять анаграмму. Отгадав одно слово в загадке, нужно переставить буквы так, чтобы получилось новое.
( Нажмите на картинку. чтобы увидеть задания)
 
МЕТАГРАММЫ — это загадки, в которых зашифрованы различные слова, состоящие из одного и того же числа букв. Разгадав одно из слов метаграммы, нужно заменить в нем одну или несколько букв так, чтобы получилось новое слово по смыслу загадки. Например, слова ОЛОВО и СЛОВО могут составить метаграмму.
( Нажмите на картинку. чтобы увидеть задания)
 
ДОМАШНЯЯ ОЛИМПИАДА
Задачи для 8-11 классов
- Напишите уравнение реакции между двумя оксидами, приводящей к образованию двух других оксидов.
- Подъемная сила какого газа в 2,25 раза меньше подъемной силы водорода (на воздухе)? Ответ подтвердите расчетом.
- Напишите уравнение реакции между: а) двумя кислотами; б) двумя кислыми солями; в) двумя основаниями.
- При растворении вещества в соляной кислоте масса раствора уменьшилась. Предложите уравнение данной реакции.
- Имеются три образца золота, алюминия и льда одинакового объема. Плотность золота 19,3 г/см3, алюминия 2,7 г/см3, льда 0,9 г/см3. В каком из образцов содержится наибольшее число атомов?
- Какие вещества вступили в реакцию, если в результате образовались следующие вещества (указаны все продукты реакции без коэффициентов): а) S + H2O; б) FeCl2 + HCl; в) MgCl2 + NH4Cl ? Напишите полные уравнения реакций.
- Определите число молекул кристаллизационной воды в кристаллогидрате сульфата алюминия, если в 6,66 г этого соединения содержится 1,806× 1023 атомов кислорода.
- В каких атомах и ионах реализуется электронная конфигурация 1s2 2s2 2p6 3s2 3p6 ? Приведите формулы и названия соединений, которые эти частицы могут образовывать между собой.
- Не очень качественная "тяжелая вода”, полученная в результате реакции кислорода с водородом, обогащенным дейтерием, имеет молярную массу 18,2 г. Рассчитайте содержание обоих изотопов в исходном водороде, считая, что кислород состоит практически только из изотопа 16О.
- При каком молярном соотношении аргона и оксида серы (IV) получается смесь, которая в 2 раза тяжелее воздуха? Сколько атомов различных элементов будет содержать 22,4 л такой смеси при нормальных условиях?
- Один из самых точных методов определения содержания спирта в крови состоит в следующем: каплю крови добавляют в раствор точно отмеренного количества K2Cr2O7 в разбавленной азотной кислоте. При этом бихромат калия окисляет этанол до уксусной кислоты. Затем определяют количество оставшегося K2Cr2O7. Напишите реакцию окисления этанола бихроматом калия в растворе азотной кислоты.Примечание: азотная кислота в этой реакции не является окислителем.
- Приведите структурную формулу и название кислоты, в которой содержание селена составляет 61,22%, а кислорода – 37,22%.
- В лаборатории синтезированы соединения, сверхпроводящие свойства которых зависят от содержания в них кислорода и связаны с наличием в их кристаллической решетке атомов меди с различной степенью окисления. Определите коэффициенты "x” для кислорода в соединениях состава La2CuOx (атомное соотношение Cu2+/Cu1+ = 7,0/3,0) и YBa2Cu3Ox (атомное соотношение Cu2+/Cu3+ = 8,5/1,5). Запишите формулы этих кристаллических веществ с целыми (не дробными) коэффициентами. Примечание: а) степень окисления La и Yравна +3; б) стехиометрические коэффициенты "x” для обоих соединений – разные.
- Кристаллическое вещество, состоящее только из элементов А и В,
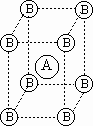 имеет кубоцентрированную элементарную ячейку (куб из атомов В, в центре которого находится атом А – данный фрагмент повторяется в кристалле бесконечно во все стороны). Определите коэффициенты "x” и "y” в формуле этого кристаллического вещества AxBy. имеет кубоцентрированную элементарную ячейку (куб из атомов В, в центре которого находится атом А – данный фрагмент повторяется в кристалле бесконечно во все стороны). Определите коэффициенты "x” и "y” в формуле этого кристаллического вещества AxBy.
- В трех разных пробирках находятся растворы хлоридов аммония, цинка, магния. С помощью только одного химического реагента установите, какое соединения находится в каждой пробирке. Приведите уравнения реакций и опишите - что будете наблюдать.
- Для переведения в растворимое состояние минералов предлагаются следующие химические операции: а) для Cu2(OH)2CO3 (малахит) – растворение в соляной кислоте; б) для Na2O× Al2O3× 2SiO2 (нефелин) – сплавление со щелочью; в) для ZnS (сфалерит) – растворение в концентрированной серной кислоте. Напишите соответствующие уравнения реакций.
- При гидролизе (реакции с водой) хлорида фосфора (V) образовалось 2,5 моля хлористого водорода. Рассчитайте массу осадка, образующегося при добавлении к полученному раствору избытка CaCl2.
- Сколько атомов кислорода и водорода содержится в 5,00 г медного купороса CuSO4× 5H2O?
- Кусочек сплава никеля и меди массой 3,714 г растворили в концентрированной азотной кислоте. При этом выделилось 2,688 л бурого газа (н.у.). Определите содержание металлов в сплаве (в % по массе).
- 1 кг вещества содержит 0,3227 г электронов. Определите формулу вещества и приведите две реакции, описывающие окислительные и восстановительные свойства данного вещества. (Масса электрона равна 1/1823 а.е.м.).
- В 10 мл 5%-ного раствора (плотность 1,10 г/мл) сильной одноосновной кислоты НЭО3 содержится 7,84× 1021 ионов. Напишите формулу кислоты
ДОМАШНЯЯ ОЛИМПИАДА
Задачи для 11 класса
- Имеется семь водных растворов, каждый объемом 500 мл, содержащих по 2 г: а) HCl; б) HNO3; в) NaOH; г) CO2; д) NH3; е) KOH; ж) KCl. Расположите эти растворы в порядке возрастания значений рН. Точный расчет не требуется.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
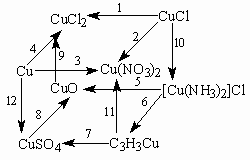
- В 200 мл раствора NaOH содержится 1,204× 1021 ионов натрия. Рассчитайте рН раствора. Как изменится значение рН при добавлении к этому раствору 100 мл 0,05 М раствора HCl?
- При растворении в воде некоторого количества пероксида натрия Na2O2 получено 400 мл раствора с рН = 14. Вычислите объем выделившегося при этом газа, если температура равна 30 оС, а давление 2 атм.
- Имеется смесь муравьиной (H-COOH), уксусной (CH3-COOH) и щавелевой (HOOC-COOH) кислот. При полном окислении 3,48 г такой смеси образуется 2,026 л углекислого газа (н.у.). На нейтрализацию такой же массы смеси понадобилось 200 г раствора гидроксида натрия с массовой долей 1,4%. Найдите массы компонентов в исходной смеси.
- Приведите пример соли, гидролиз которой приводит к выделению газа и выпадению осадка. Напишите уравнение реакции гидролиза.
- Нарисуйте структурную формулу ацетата аммония (аммониевой соли уксусной кислоты) и укажите гибридизацию атомов углерода и азота в этом соединении. Предложите способ синтеза ацетата аммония из неорганических веществ.
- Какое из веществ проявляет более сильные кислотные свойства: фенол или 4-нитрофенол? Ответ мотивируйте.
- Определите молекулярную формулу фторпроизводного бутена, если известно, что оно содержит 4,545% водорода по массе. Напишите структурные формулы по крайней мере трех изомеров данного вещества, имеющих цис-строение.
- Существует только один гексин, способный существовать в оптически активной форме. Напишите структурную формулу этого гексина и назовите его. Как химическим путем отличить этот гексин от гексина-2 и гексина-3 (желательна качественная реакция)? Что получится в реакции Кучерова с искомым гексином? Назовите продукт реакции.
- Напишите уравнения реакций, соответствующие следующей последовательности превращений. Назовите вещества А-F :
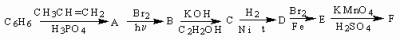
- Предложите возможную структурную формулу вещества, о котором известно, что оно: а) реагирует с карбонатом натрия; б) не реагирует сHBr; в) реагирует с подкисленным раствором перманганата калия; г) содержит 4 атома углерода; д) оптически активно. Напишите схемы соответствующих реакций и укажите асимметрический атом углерода.
- В одной рукописи было написано: "Все кислоты делятся на одно-, двух- и трехосновные по числу содержащихся в них атомов водорода”. Приведите несколько качественно различных примеров кислот, содержащих атомы водорода, но не попадающих под это определение.
- Напишите формулу органического соединения, содержащего 29,4% водорода по массе. Такое соединение может быть не одно. Предложите способ синтеза простейшего из них из неорганических веществ.
|
 |
| Календарь |
| « Май 2024 » | | Пн | Вт | Ср | Чт | Пт | Сб | Вс | | | | 1 | 2 | 3 | 4 | 5 | | 6 | 7 | 8 | 9 | 10 | 11 | 12 | | 13 | 14 | 15 | 16 | 17 | 18 | 19 | | 20 | 21 | 22 | 23 | 24 | 25 | 26 | | 27 | 28 | 29 | 30 | 31 |
|
|


 Приветствую Вас Гость | RSS
Приветствую Вас Гость | RSS